Investigación clínica
Autor: Guillermo Martínez Díaz-Guerra, Hospital Universitario 12 de Octubre, Universidad Complutense de Madrid.
The Effect of Fracture Recency on Observed 10-Year Fracture Probability: A Registry-Based Cohort Study.
Leslie WD, Morin SN, Lix LM, McCloskey EV, Johansson H, Harvey NC, Kanis JA.
J Bone Miner Res. 2022 May;37(5):848-855. doi: 10.1002/jbmr.4526.
El riesgo de fractura por fragilidad es mayor en los 2 primeros años post-fractura, y se conoce como riesgo inminente. En el momento actual, el principal calculador del riesgo de fracturas osteoporóticas a 10 años (FRAX) no contempla la fractura reciente ni tampoco la localización de la fractura previa.
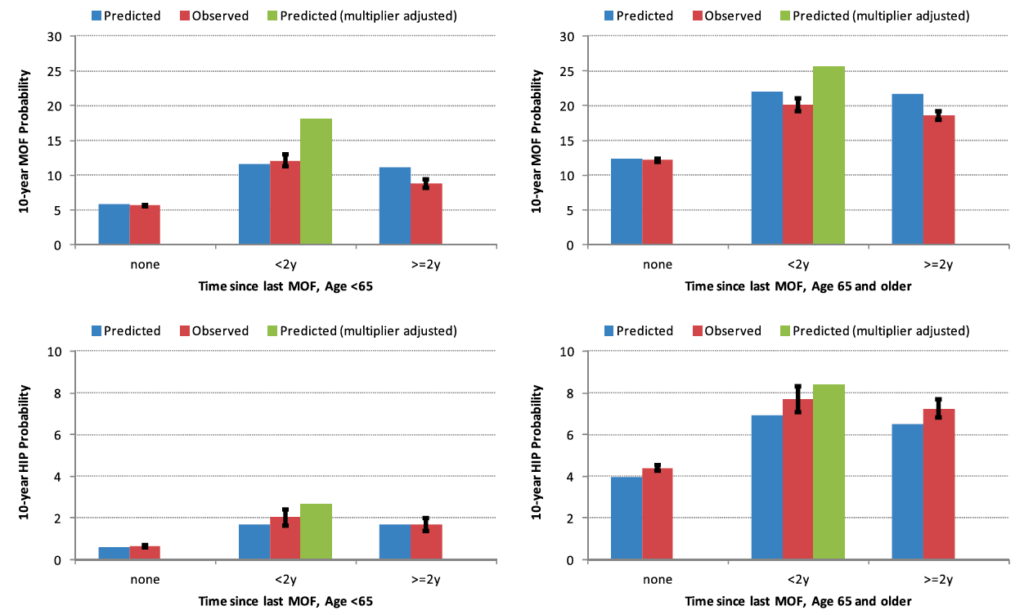
En el registro Manitoba Bone Mineral Density Program, con determinación de BMD y FRAX basales en mujeres de más de 40 años se registraron las fracturas observadas durante 10 años de seguimiento y se compararon con las previstas por el cálculo del FRAX basal. Se realizó estratificación en función del estatus fracturario previo a la fractura registrada: no fractura previa , fractura reciente (<2 años), o fractura remota (≥ 2 años), así como edad menor de 65 años, o igual o mayor de 65 años. La probabilidad observada fue similar a la probabilidad prevista por FRAX independiente del status previo de fractura (ratio fr.observadas/previstas ~ 1, ver figura 1). Cuando se analizó el efecto de factores multiplicadores del riesgo FRAX basal propuestos en estudios previos en el subgrupo con fracturas recientes, se vio que el riesgo previsto sobreestimaba el número de fracturas reales. Sólo en el subgrupo de mujeres < 65 años se vio un efecto significativo de la fractura vertebral reciente (O/P 1.61) y de la fractura de húmero reciente (O/P 1.48). No se vio efecto de la fractura de cadera o de antebrazo reciente.
Como conclusión del estudio, se puede señalar que aunque se confirma el exceso de riesgo asociado a la fractura previa, este riesgo no es consistente entre las distintas localizaciones y es de menor magnitud que el reportado en estudios previos.
Bone Mineral Density and Bone Turnover 10 Years After a Single 5 mg Dose or Two 5-Yearly Lower Doses of Zoledronate in Osteopenic Older Women: An Open-Label Extension of a Randomized Controlled Trial.
Grey A, Bolland MJ, Horne A, Mihov B, Gamble G, Reid IR. J Bone Miner Res. 2022 Jan;37(1):3-11. doi: 10.1002/jbmr.4453.
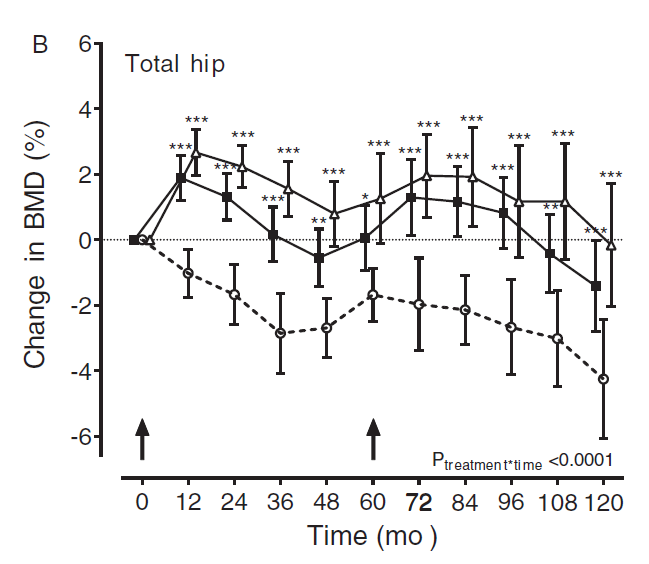
El efecto de dosis más bajas y menos frecuentes de las comúnmente utilizadas con ácido zoledrónico para el tratamiento de la osteoporosis es desconocido. En este ensayo clínico aleatorizado, doble ciego y controlado con placebo se compararon los efectos sobre BMD y marcadores de remodelado durante 10 años en 180 mujeres postmenopaúsicas con osteopenia sin fracturas de 3 dosis de zoledrónico ( 5 mg IV administrados en dosis única, vs placebo) y 2,5 mg, 1 mg o placebo administrados cada 5 años. La BMD lumbar se mantuvo significativamente más alta respecto al grupo placebo en el grupo de zoledrónico 5 mg, mientras que los niveles de β-CTX se mantuvieron 25% por debajo del grupo placebo. Más aún, observaron que dosis de 2.5 mg cada 5 años son capaces de mantener la BMD de cadera y columna por encima de los valores basales, manteniendo los niveles de β-CTX 20% por debajo del grupo placebo
durante 10 años de seguimiento (Fig. 2). A la vista de estos resultados, se puede concluir que dosis más bajas y menos frecuentes de zoledronato de las comúnmente utilizadas ( 5mg IV una vez al año) tienen efecto antirresortivo muy prolongado y mantienen la masa ósea en el esqueleto axial hasta 10 años. No obstante, es necesario estudiar sus efectos sobre el riesgo de fracturas en mujeres de alto riesgo antes de poder recomendar esta pauta.

Romosozumab and antiresorptive treatment: the importance of treatment sequence. Cosman F, Kendler DL, Langdahl BL, Leder BZ, Lewiecki EM, Miyauchi A, Rojeski M, McDermott M, Oates MK, Milmont CE, Libanati C, Ferrari S. Osteoporos Int. 2022 Jun;33(6):1243-1256. doi: 10.1007/s00198-021-06174-0.
El tratamiento con teriparatida seguido de un antirresortivo produce mayores incrementos de BMD que cuando se usa un antirresortivo en primer lugar, por lo que esta secuencia de tratamiento es la habitualmente recomendada en pacientes de alto riesgo de fractura.
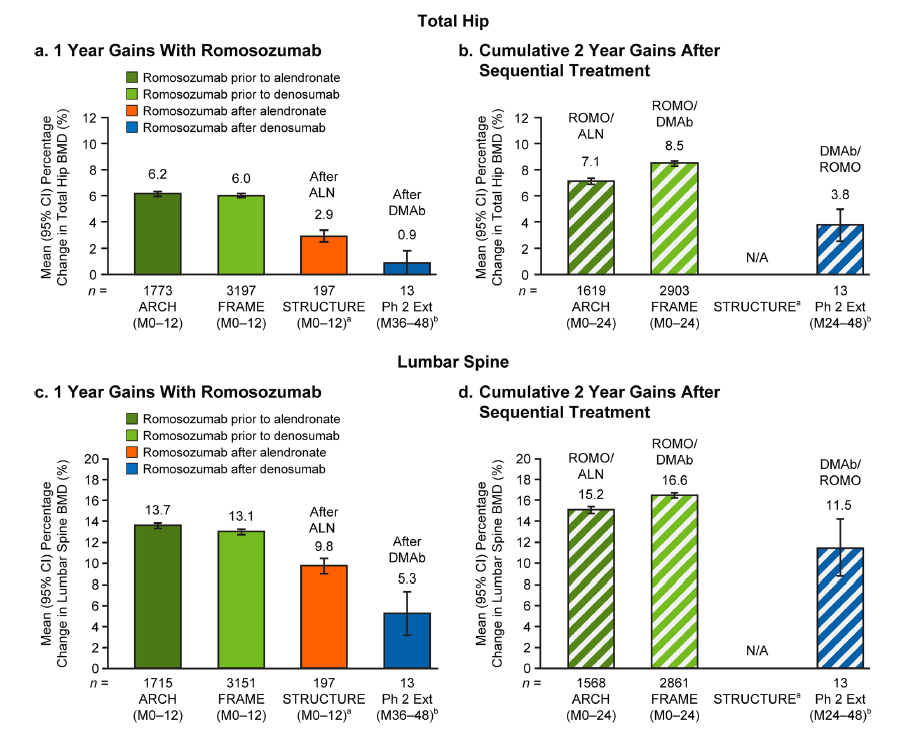
El objetivo de este trabajo es evaluar si la secuencia del tratamiento afecta también a la respuesta a romosozumab como ocurre en el caso de teriparatida. Se realizó una revisión de los ensayos clínicos aleatorizados donde romosozumab se administró antes (ARCH, FRAME), o después (STRUCTURE, Fase 2 extensión) de un antirresortivo (alendronato, denosumab). Se evaluó el porcentaje de cambio de la BMD en cadera total (TH), y columna lumbar (CL), y las tasas de respuesta ( cambio BMD ≥3% y ≥6%) a los 12 y 24 meses (excepto en el estudio STRUCTURE, sólo 12 meses disponibles).
Aunque no se trata de comparaciones directas – las características basales de las pacientes en los distintos estudios no eran las mismas y tampoco el riesgo basal de fractura- puede comprobarse que se producen mayores ganancias de BMD tanto a nivel lumbar como de la cadera total cuando el romosozumab se administraba antes del tratamiento antirresortivo con denosumab o alendronato (Fig.3). Más aún, si se tenía en cuenta el porcentaje de mujeres en el que la ganancia de masa ósea en cadera total era superior al 6%, este porcentaje de respondedoras era mayor en la secuencia romosozumab/denosumab (69%) que en la secuencia inversa (15%). Este punto es relevante ya que la magnitud del cambio en la BMD de cadera se considera actualmente un parámetro subrogado válido de la eficacia en reducción del riesgo de fractura. En concreto ganancias mayores del 6% se asocian con una reducción del 40% en el riesgo de fractura de cadera (Bouxsein, JBMR 2019).
La conclusión del estudio por tanto es que en pacientes con muy alto riesgo de fractura, la secuencia de 1 año de romosozumab, seguida de tratamiento antirresortivo debería ser la opción elegida en pacientes de muy alto riesgo de fractura.
Bisphosphonates and the risk of atypical femur fractures
Black DM, Condra K, Adams AL, Eastell R.
Bone. 2022 Mar;156:116297. doi: 10.1016/j.bone.2021.116297.
Los bisfosfonatos (BFs) reducen de forma efectiva el riesgo de fractura de cadera y otras fracturas. La preocupación por las fracturas atípicas femorales (AFF) ha hecho decrecer su prescripción. El objetivo de este estudio fue investigar la contribución de los BFs al riesgo de AFF incluyendo otros factores de riesgo como BMD, edad, peso y raza. Para ello, se diseñó un estudio epidemiológico prospectivo, en el que se evaluaron 196.129 mujeres ≥50 años pertenecientes a la cohorte Southern California Kaiser Permanente con al menos una prescripción de bifosfonatos. Como variable principal, se recogieron las fracturas atípicas adjudicadas mediante radiografías en el período 2007 – 2017. Mediante un análisis de modelos multivariante de Cox, se calculó el cociente
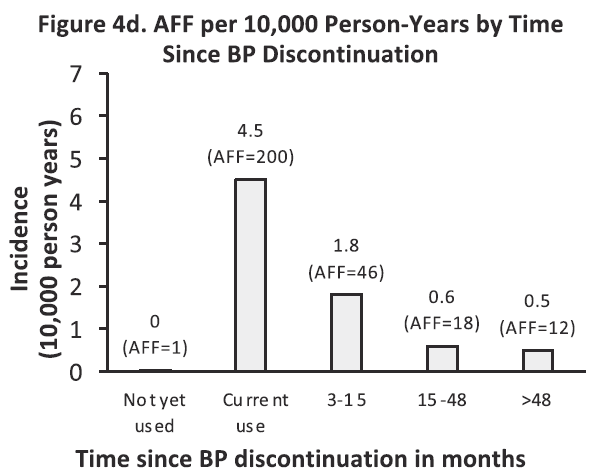
beneficio/riesgo (fracturas prevenidas/AFF) modelado para un período de 1-10 años. Se recogieron 277 AFF (0.1% de la cohorte). Tras el ajuste multivariante el riesgo de AFF se incrementó con la duración del tratamiento con BFs (Hazard ratio HR=8.9 para 3-5 años y HR=43.5 para tratamiento superiores a 8 años). La BMD de cadera no se asoció con el riesgo de AFF. Otros factores de riesgo identificados fueron: raza asiática, talla baja, sobrepeso y tratamiento con glucocorticoides. El beneficio en la reducción del riesgo de fracturas sobrepasó ampliamente el riesgo de AFF. En concreto, en mujeres de raza caucásica 3 años de tratamiento con BFs previenen 149 fracturas de cadera y se asocian con sólo 2 AFF. La discontinuación de los BFs se asoció con un rápido descenso del riesgo de AFF (Fig.4).
Como conclusión del estudio, señalar que los beneficios de los bifosfonatos en reducción del riego de fractura superan el riesgo de fracturas atípicas y la rápida reducción del riesgo de AFF tras la discontinuación junto con el efecto residual del bisfosfonato pone en valor las vacaciones terapeúticas.
Supplemental Vitamin D and Incident Fractures in Midlife and Older Adults
LeBoff MS, Chou SH, Ratliff KA, Cook NR, Khurana B, Kim E, Cawthon PM, Bauer DC, Black D, Gallagher JC, Lee IM, Buring JE, Manson JE.
N Engl J Med. 2022 Jul 28;387(4):299-309. doi: 10.1056/NEJMoa2202106.
Se trata de un estudio en paralelo del conocido estudio VITAL. El estudio VITAL es un ensayo clínico aleatorizado, controlado con placebo, con un diseño factorial 2×2 que investigaba si la suplementación con vitamina D (colecalciferol 2.000 UI diarias), ácidos grasos omega-3 (1 gr/d) o ambos era capaz de prevenir el cáncer y la enfermedad cardiovascular en varones de 50 o más años y en mujeres de 55 o más años. Como es ya conocido, los resultados de este estudio fueron negativos puesto que no se observaron efectos significativos en la enfermedad cardiovascular o la incidencia de cáncer durante 5.3 años (Manson JA, N Engl J Med 2019) y por tanto no confirmaba la asociación observada de la vitamina D con estas patologías en estudios observacionales previos.
En el presente subestudio del VITAL se investigaba si los suplementos de vitamina D (Colecalciferol 2.000 UI/día) disminuían el riesgo de fracturas incidentes totales, no vertebrales y de cadera en comparación con placebo. Los participantes no fueron reclutados en base a deficiencia de vitamina D, baja masa ósea u osteoporosis. En los más de 25.000 participantes de ambos sexos incluidos los suplementos de vitamina D no tuvieron ningún efecto significativo sobre las fracturas totales, no vertebrales y de cadera durante 5.3 años. No se observaron tampoco efectos significativos en el análisis por subrupos (edad, sexo, raza, índice de masa corporal o niveles basales de 25-OHvitamina D).
Si bien los resultados del estudio fueron negativos, es importante incidir en el hecho de que se trataba de población mayoritariamente sana y no deficiente en vitamina D. A este respecto, debemos recordar que la vitamina D es un nutriente y que cantidades moderadas son suficientes para la salud ósea de la población general. El Instituto de Medicina (actual National Academy of Medicine) ya recomendaba en 2011 una ingesta dietética de 600 a 800 UI diarias de vitamina D, ya que éstas cubren las necesidades de la salud ósea en el 97.5% de la población general (RDA). Por este
motivo, organizaciones como la National Academy of Medicine o la US Preventive Task Force señalan que no deben realizarse determinaciones de 25-OH vitamina D de forma universal, ni administrar vitamina D a la población general. Por el contrario, los esfuerzos deben dirigirse a la población de riesgo: ancianos institucionalizados, situaciones de malabsorción (p.ej enf celíaca, by-pass gástrico), o pacientes con osteoporosis en tratamiento con fármacos, en los que la vitamina D debe administrarse siempre conjuntamente con calcio.
Investigación básica
Autora: Mercedes Giner García. Profesora del Dpto. de Citología e Histología Normal y Patológica de la Facultad de Medicina de Sevilla.
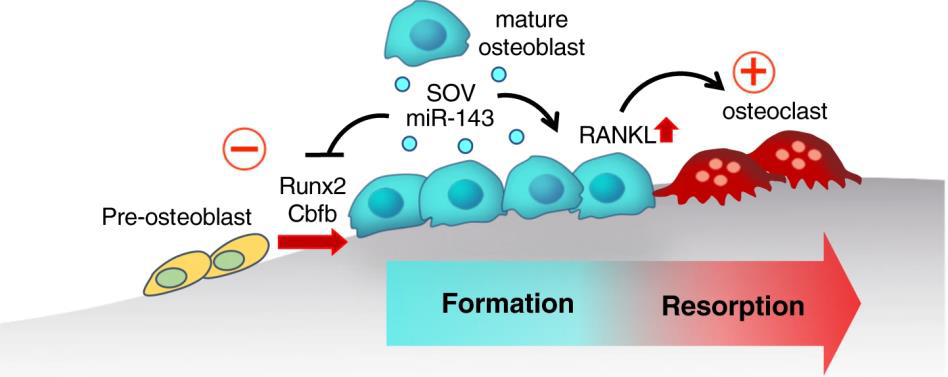
NUEVA COMUNICACIÓN ENTRE OSTEOBLASTOS MADUROS MEDIANTE VESÍCULAS EXTRACELULARES QUE INDUCE LA TRANSICIÓN DINÁMICA ENTRE LA FASE DE FORMACIÓN Y REABSORCIÓN ÓSEA.
Uenaka M, Yamashita E, Kikuta J, Morimoto A, Ao T, Mizuno H, Furuya M, Hasegawa T, Tsukazaki H, Sudo T, Nishikawa K, Okuzaki D, Motooka D, Kosaka N, Sugihara F, Boettger T, Braun T, Ochiya T, Ishii M. Osteoblast-derived vesicles induce a switch from bone-formation to bone-resorption in vivo. Nat Commun. 2022 Feb 24;13(1):1066. doi: 10.1038/s41467-022-28673-2. PMID: 35210428; PMCID: PMC8873258.
El metabolismo óseo está regulado por la actividad cooperativa entre los osteoblastos y los osteoclastos. Sin embargo, los mecanismos que intervienen en el cambio entre las fases osteoblástica y osteoclástica no se han dilucidado por completo. En el artículo, identifican unas vesículas extracelulares, de aprox 400nm, derivadas de osteoblastos maduros que inhiben la formación ósea y mejoran la osteoclastogénesis. Las imágenes intravitales de ratones transgénicos revelan que los osteoblastos maduros secretan y capturan vesículas extracelulares, denominadas pequeñas vesículas de osteoblastos (SOV), presentan una acción autocrina y paracrina. Los experimentos con células MC3T3 demuestran que las SOV suprimen la diferenciación de osteoblastos (disminuyen expresión de RunX2 y Sp7) e inducen la ostaclastogénesis (mejoran la expresión del activador del receptor del ligando NF-κB). También describen que SOV están enriquecidas de miR-143, y comprueban el efector inhibidor de miR-143 sobre la osteoblastogénesis, a través de su unión a Cbfb pero no demuestran el efecto directo activador sobre la osteoclastogénesis lo que deben estar otros factores de las SOV implicados en ese proceso.
En resumen, identifican las SOV como un modo de comunicación de célula a célula, controlando la transición dinámica de las fases de formación a reabsorción de hueso in vivo en un mecanismo dependiente de miR-143.
SP7 JUEGA UN PAPEL IMPORTANTE EN LA OSTEOCITOGÉNESIS
Wang JS, Kamath T, Mazur CM, Mirzamohammadi F, Rotter D, Hojo H, Castro CD, Tokavanich N, Patel R, Govea N, Enishi T, Wu Y, da Silva Martins J, Bruce M, Brooks DJ, Bouxsein ML, Tokarz D, Lin CP, Abdul A, Macosko EZ, Fiscaletti M, Munns CF, Ryder P, Kost-Alimova M, Byrne P, Cimini B, Fujiwara M, Kronenberg HM, Wein MN. Control of osteocyte dendrite formation by Sp7 and its target gene osteocrin. Nat Commun. 2021 Nov 1;12(1):6271. doi: 10.1038/s41467-021-26571-7. PMID: 34725346; PMCID: PMC8560803.
Los principales tipos de células que gobiernan la homeostasis ósea son los osteoblastos, los osteoclastos y los osteocitos. Aunque se han estudiado bien las funciones de los osteoblastos y los osteoclastos en la formación y resorción ósea, las funciones de los osteocitos, el tipo de célula más abundante en el hueso, se han pasado por alto debido a las limitaciones tecnológicas y a la ubicación relativamente inaccesible de las células dentro de la matriz ósea mineralizada. Estas células traducen señales externas, como variaciones hormonales y tensiones mecánicas, en cambios en la remodelación ósea al secretar factores de acción paracrina que regulan la actividad de los osteoblastos y los osteoclastos (Dallas, 2013). Además, los osteocitos tienen una morfología única, ya que tienen múltiples prolongaciones dendríticas similares a neuronas que se proyectan a través del sistema canalicular lacunar del hueso. La red dendrítica de los osteocitos confiere mecanosensibilidad a estas células y permite una amplia comunicación entre los osteocitos y las células adyacentes en las superficies óseas. Los defectos en la red de dendritas de osteocitos pueden causar fragilidad esquelética en el contexto del envejecimiento y el tratamiento con glucocorticoides (Tiede-Lewis, 2019). Estimaciones recientes sugieren que la red de conectividad de osteocitos en el hueso humano exhibe el mismo orden de complejidad que la red de conexiones entre neuronas en el cerebro (Buenzli, 2015). Se desconocen los factores de transcripción que definen el linaje que coordinan los programas genéticos asociados con la maduración de los osteocitos.
El objetivo de este estudio fue definir los circuitos reguladores de genes clave que impulsan la diferenciación de osteocitos y la formación de dendritas.
En este trabajo, eliminan Sp7 en osteoblastos y osteocitos maduros y observamos un fenotipo esquelético dramático que incluye porosidad cortical, aumento de la apoptosis de osteocitos y defectos severos en las dendritas de osteocitos. El estudio de los genes diana de Sp7 y los sitios de unión al ADN en los osteocitos revela un papel específico para este factor de transcripción durante la osteocitogénesis. Los genes diana Sp7 específicos de los osteocitos tienen sitios de unión al ADN distintos de los de los osteoblastos y están muy enriquecidos en genes expresados en las neuronas, lo que
destaca los vínculos moleculares compartidos entre las redes de comunicación intercelular en el cerebro y los huesos. Entre los genes diana Sp7 específicos de osteocitos, identifican a la osteocrina como un factor secretado que promueve la formación/mantenimiento de dendritas de osteocitos in vitro e in vivo. Finalmente, muestran defectos evidentes en las dendritas de osteocitos en humanos con fragilidad ósea debido a la rara mutación SP7R316C.
En conjunto, demuestran que Sp7 orquesta la osteocitogénesis a través de un conjunto de genes diana que promueven la formación y el mantenimiento óptimo de las dendritas de los osteocitos. La osteocrina, un factor secretado regulado positivamente por Sp7, puede rescatar la morfología de los osteocitos y los defectos de supervivencia en ratones con deficiencia de Sp7. Estos hallazgos resaltan las características compartidas entre la conectividad osteocítica y neuronal y destacan los pasos en la osteocitogénesis que pueden tener como objetivo mejorar la resistencia ósea de las personas con osteoporosis.
- Dallas, S. L., Prideaux, M. & Bonewald, L. F. The osteocyte: an endocrine cell… and more. Endocr. Rev. 34, 658–690 (2013).
- Tiede-Lewis, L. M. & Dallas, S. L. Changes in the osteocyte lacunocanalicular network with aging. Bone 122, 101–113 (2019).
- Buenzli, P. R. & Sims, N. A. Quantifying the osteocyte network in the human skeleton. Bone 75, 144–150 (2015).
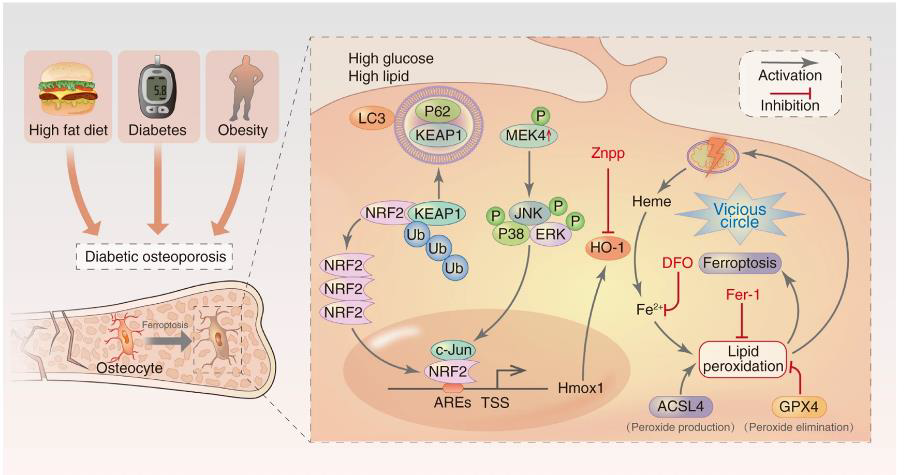
EL MICROAMBIENTE DIABÉTICO INDUCE LA MUERTE CELULAR DE LOS SOTEOCITOS POR FERROPTOSIS
Yang Y, Lin Y, Wang M, Yuan K, Wang Q, Mu P, Du J, Yu Z, Yang S, Huang K, Wang Y, Li H, Tang T. Targeting ferroptosis suppresses osteocyte glucolipotoxicity and alleviates diabetic osteoporosis. Bone Res. 2022 Mar 9;10(1):26. doi: 10.1038/s41413-022-00198-w. PMID: 35260560; PMCID: PMC8904790.
La osteoporosis diabética (OPDM), una de las principales causas de fractura por fragilidad y deterioro trabecular en personas con diabetes, se considera actualmente una complicación musculoesquelética a largo plazo de la diabetes mellitus (DM). Durante la última década, se ha descrito como el microambiente diabético afecta a la homeostasis mineral, pero quedan por investigar los mecanismos fisiopatológicos subyacentes que inducen a ellos.
Los osteocitos son las células más abundantes en el tejido óseo mineralizado y estudios anteriores han demostrado que la función de los osteocitos está fuertemente asociada con la salud ósea y que la muerte de estas células podría alterar drásticamente la microarquitectura ósea (He et al.,2020), además, numerosos estudios recientes han demostrado que los osteocitos juegan un papel vital en la OPDM (Eckhardt, 2020 and Yang, 2020).
La ferroptosis es una nueva forma de muerte celular programada inducida por la peroxidación lipídica dependiente de hierro descontrolada. A diferencia de otras formas de muerte celular, la ferroptosis tiene características biológicas únicas, como la acumulación de hierro, el aumento de la producción de peróxido de lípidos y la desregulación de la glutatión peroxidasa 4 (GPX4). Varios estudios han indicado que la ferroptosis está involucrada en diferentes tipos de enfermedad: miocardiopatía, neurodegeneración, lesión por isquemia-reperfusión y los efectos de la inmunoterapia contra el cáncer…
Recientemente se ha publicado una fuerte relación entre el metabolismo glucídico y la ferroptosis (Cui, 2021). En este estudio, se estableció un modelo de ratón de OPDM y confirman el papel crucial de la ferroptosis en la muerte de osteocitos inducida por OPDM tanto in vivo como in vitro. Molecularmente, la expresión de hemo-oxidasa-1 (HO-1), regulada al alza, conduce a la degradación del grupo hemo y a la sobrecarga de hierro intracelular, lo que provoca la peroxidación de lípidos. Este proceso depende de la unión directa entre el factor nuclear 2 (NRF2) y c-JUN. Además, la ferroptosis rescató
significativamente la muerte de osteocitos y el deterioro trabecular. Estos resultados brindan información sobre el mecanismo subyacente de la OPDM y sugieren un posible objetivo terapéutico para futuras estrategias de tratamiento de la OPDM.
- He, Z. et al. Irisin inhibits osteocyte apoptosis by activating the Erk signaling pathway in vitro and attenuates ALCT-induced osteoarthritis in mice. Bone 141, 115573 (2020).
- Eckhardt, B. A. et al. Accelerated osteocyte senescence and skeletal fragility in mice with type 2 diabetes. JCI Insight 5, 9 (2020).
- Yang, L. et al. High glucose downregulates connexin 43 expression and its gap junction and hemichannel function in osteocyte-like MLO-Y4 cells through activation of the p38MAPK/ERK signal pathway. Diabetes Metab. Syndr. Obes. 13, 545–557 (2020).
LAS CÉLULAS SENESCENTES MSC INTERVIENEN EN LA REPARACIÓN ÓSEA
Saul D, Monroe DG, Rowsey JL, Kosinsky RL, Vos SJ, Doolittle ML, Farr JN, Khosla S. Modulation of fracture healing by the transient accumulation of senescent cells. Elife. 2021 Oct 7;10:e69958. doi: 10.7554/eLife.69958. PMID: 34617510; PMCID: PMC8526061.
El número de fracturas por fragilidad a nivel mundial está creciendo. Una de las razones de este importante problema de salud pública es el envejecimiento de la población, que se asocia con un deterioro fisiológico progresivo, lo que lleva a un mayor riesgo de muchas enfermedades crónicas. Las características del envejecimiento que impulsan este deterioro incluyen la inestabilidad genómica, el desgaste de los telómeros, las alteraciones epigenéticas, la pérdida de proteostasis, la detección de nutrientes desregulada, la disfunción mitocondrial, el agotamiento de las células madre, la comunicación intercelular alterada y la senescencia celular (López-Otín, 2013). Recientemente, la senescencia celular ha surgido como un objetivo terapéutico prometedor para prevenir el envejecimiento de múltiples tejidos, incluido el sistema musculoesquelético.
Al igual que en otros tejidos, las células senescentes se acumulan dentro del microambiente óseo envejecido y son causales en la patogenia de la pérdida ósea relacionada con la edad. Una característica clave del programa de senescencia celular es la activación de los inhibidores de la cinasa dependiente de ciclina (CDKI), Cdkn2 y Cdkn1, en paralelo con la resistencia a la apoptosis a través de la regulación positiva de las vías antiapoptóticas de las células senescentes. Junto con una mayor expresión de CDKI, las células senescentes desarrollan un fenotipo secretor asociado a la senescencia (SASP), que consiste en citocinas proinflamatorias, quimiocinas y proteínas que degradan la matriz extracelular que pueden impulsar la disfunción tisular a través de la señalización intercelular paracrina y sistémica, y propagar la senescencia celular a través del llamado ‘efecto espectador’ (Lagnado, 2021). Estos efectos perjudiciales pueden aliviarse eliminando las células senescentes, ya sea genéticamente o mediante la administración de senolíticos, medicamentos que eliminan selectivamente las células senescentes. Por ejemplo, se ha demostrado que la administración intermitente del cóctel senolítico Dasatinib, un inhibidor de la tirosina cinasa, más quercetina (flavonoide natural) elimina las células senescentes en ratones viejos y en humanos. Por otro lado, Dasatinib+quercetina en estudios preclínicos, retarda la aparición del envejecimiento mediante la prevención de múltiples comorbilidades para extender así la vida útil. Estos hallazgos ahora se están traduciendo a humanos en diversos ensayos clínicos.
Los objetivos de este estudio fueron caracterizar la apariencia potencial de las células senescentes durante la curación de fracturas y establecer si el objetivo de la senescencia celular con senolíticos afecta la dinámica de curación de las fracturas.
Se centraron en la curación de fracturas en ratones adultos jóvenes para evitar los efectos de confusión de la senescencia con el envejecimiento. Primero definen los perfiles transcripcionales del callo de curación y realizan una caracterización en profundidad de la senescencia celular en varios momentos. Luego a partir de un modelo de ratón validan la aparición y desaparición de las células senescentes in vivo. Finalmente, tratan a ratones fracturados adultos jóvenes con senolíticos para evaluar si la eliminación de células senescentes afectaba negativamente la curación de la fractura.
En resumen, demuestran que la senescencia celular está presente en el desarrollo del callo de fractura. Establecen el curso temporal de la expresión de Cdkn2aInk4a o Cdkn1aCip1 durante la curación de fracturas, asociados a componentes SASP, encontrando un máximo de células senescente a los 14 días post-fractura con fenotipo Cdkn2. En conjunto, los hallazgos tienen implicaciones clínicas para el desarrollo de terapias senolíticas para la osteoporosis y también tienen relevancia biológica para el concepto de células senescentes como facilitadoras de la curación, ya que estos efectos beneficiosos versus perjudiciales de las células senescentes en la reparación de lesiones pueden variar entre tejidos.
- López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell. 2013 Jun 6;153(6):1194-217. doi: 10.1016/j.cell.2013.05.039. PMID: 23746838; PMCID: PMC3836174.
- Lagnado A, Leslie J, Ruchaud-Sparagano MH, et al. Neutrophils induce paracrine telomere dysfunction and senescence in ROS-dependent manner. EMBO J. 2021 May 3;40(9):e106048. doi: 10.15252/embj.2020106048. PMID: 33764576; PMCID: PMC8090854.












